AD-HIES oder HIES oder Hiob-Syndrom ist ein primärer Immundefekt, der erstmals 1966 von Davis et al. beschrieben wurde und durch eine dominant negative Mutationen in STAT3 verursacht wird.
STAT3 spielt eine Schlüsselrolle bei der Entwicklung von Wirbeltieren und der Funktion von reifem Gewebe, einschließlich der Kontrolle von Entzündungen und Immunität.
Das Syndrom ist durch eine Reihe immunologischer und infektiöser Krankheitsmanifestationen, sowie durch ein breites Spektrum nicht-immunologischer Merkmale gekennzeichnet. AD- HIES ist eine sehr seltene Krankheit. Die jährliche Inzidenz wird auf weniger als Eins pro Million (1/1000000) geschätzt. Das Syndrom betrifft Männer und Frauen gleichermaßen, da das Gen auf Chromosom 17 liegt.
Die meisten Fälle von HIES treten sporadisch auf, werden also nicht vererbt. Es handelt sich um De-novo-Mutationen. Wenn also zwei gesunde Eltern ein HIES Kind haben und eine dominant negative Mutation durch Sequenzierung bestätigt wurde, dann ist es relativ ausgeschlossen, dass weitere Kinder die selbe Mutation bekommen. (3)
Klinische Phänotyp
Der klinische Phänotyp von AD-HIES umfasst die folgenden Erscheinungsformen
- Infektiöse Komplikationen:
- Hautinfektionen – so genannte “kalte” Abszesse, die hauptsächlich durch Staphylococcus aureus verursacht werden.
- Ekzematöse Hautausschläge, die bereits in der Neugeborenenperiode auftreten.
- Wiederkehrende sinopulmonale (Atemwege) Infektionen, die durch Staphylococcus aureus, Streptococcus pneumoniae und Haemophilus-Arten verursacht werden. Diese Infektionen tragen zur Bildung von Bronchiektasien, Lungenschäden und Pneumatozelen bei. Pneumatozelen sind Luft-gefüllte Zysten, welche durch einen Ventilmechanismus im Lungengewebe entstehen. Pneumatozelen bilden einen Ort für chronische Infektionen mit Pseudomonas aeruginosa, Mykobakterien, Aspergillus und Pneumocystis jirovecii-Pneumonie.
- Chronische mukokutane Candidose (CMC) und andere Pilzerreger, einschließlich Histoplasma, Coccidioides und Cryptococcus. Diese Erreger werden hauptsächlich bei Magen-Darm-Infektionen und Meningitis vermutet.
- Varicella-zoster-Virus (VZV)-Reaktivierung (Gürtelrose) und Epstein-Barr-Virus (EBV)-Virämie. Virämie ist das Vorhandensein von Viren im Blut.
- Abnorme kraniofaziale Merkmale:
Charakteristisches Gesicht, Kraniosynostose, zurückgebliebenes Kindheitsgebiss
und hochgewölbter Gaumen. - Muskuloskelettale Anomalien:
Überstreckbarkeit, Skoliose, Osteoporose, Frakturen mit minimalem Trauma, Erkrankungen der Halswirbelsäule im vierten und fünften Lebensjahrzehnt, die eine chirurgische Stabilisierung erfordern können. - Gefäßanomalien:
Tortuosität (Windungen) der Koronararterien, Aneurysmen und Bluthochdruck. - Hirnläsionen unbekannter Ursache.
- Erhöhtes Risiko der Entwicklung bösartiger Erkrankungen, insbesondere Non-Hodgkin-Lymphome (NHL). Non-Hodgkin-Lymphome sind eine heterogene Gruppe von Krebserkrankungen, die von Zellen des lymphatischen Systems, sogenannten Lymphozyten, ausgehen.
Von den 65 Personen mit AD-HIES im jüngsten USIDNET-Register waren fast 25 % (16/65) voll aktiv und hatten keine Krankheitsanzeichen. Ein Prozentsatz von 64 % (42/65) wies eine leichte Beeinträchtigung auf, und die restlichen 11 % (7/65) berichteten über eine erhebliche Beeinträchtigung. Insgesamt 23 % (15/65) wiesen eine Ateminsuffizienz auf. Das klinische Bild verbesserte sich tendenziell mit der Zeit, was wahrscheinlich auf eine korrekte Diagnose und eine angemessenere Behandlung zurückzuführen ist, außer bei Patienten mit fortschreitender Lungeninsuffizienz und chronischer Bronchialvereiterung. Bei den meisten Patienten tritt die erste Infektion sehr früh im Leben auf, wobei bei 39 % der Patienten eine neonatale Infektion und bei 81 % (48/59) der Patienten eine Infektion im ersten Lebensjahr festgestellt wurde.(Stand 2020 *1)
Laborwerte
Zu den Laborbefunden bei AD-HIES gehören Eosinophilie (Granulozyten die Säure-Base-Reaktionen regulieren) und IgE, das in der Regel über 2000 IE/ml und häufig über 20 000 IE/ml erhöht ist.
Interessanterweise zeigen Personen mit HIES selten Allergien oder Unverträglichkeiten gegen Nahrungsmittel. Die Serum-IgG- und IgM-Werte sind in der Regel normal, und die Serum-IgA-Werte sind normal oder niedrig; bei einigen Patienten mit HIES werden jedoch gestörte spezifische Antikörperreaktionen beobachtet. Die Phänotypisierung der Lymphozyten zeigt häufig verminderte T-Gedächtniszellen (CD45RO+), B-Gedächtniszellen und verminderte CD27+ B-Zellen. (1)
Mutationsanalysen
Mehrere Arbeitsgruppen haben das Spektrum der STAT3-Moleküldefekte untersucht. Diese sind hauptsächlich Funktionsverlust des Gens und dies ist dominant negativ. Der Mensch hat einen doppelten Satz Gene. Einen vom Vater und einen von der Mutter. Dominant negativ heißt, dass nicht, wie oft üblich, das gesunde Gen für das defekte einspringen kann. Das defekte Gen ist sozusagen dominant.

Es wurden bisher 54 verschiedene pathogene Gendefekte hinterlegt (Stand Oktober 2022).
Bisher wurden etwa 80 STAT3-Mutationen der Datenbank gemeldet, von denen die überwiegende Mehrheit (54) pathogene Varianten sind. Das ist eine Sequenzvariante, bei der eine oder mehrere Basen (Nukleotide) verändert sind, was zu einer anderen Aminosäuresequenz führt, durch die das Protein einen Funktionsverlust hat.
Info hierzu:
Nukleinbasen, kurz Basen, sind ein Bestandteil von Nukleotiden und somit der Bausteine von Nukleinsäuren also von RNA und DNA. In der DNA treten die vier Basen Adenin (A), Guanin (G), Cytosin (C) und Thymin (T) auf. Drei Basen codieren für eine Aminosäure. Ist also eine Base anders, bekommt man folglich eine andere Aminosäure. Eine bestimmte Aminosäuresequenz ergibt das Protein. Egal wie die Sequenz verändert ist, es entsteht meist ein anderes Protein, das nicht so funktionieren kann. Dies nennt die Wissenschaft LOF – loos of function.
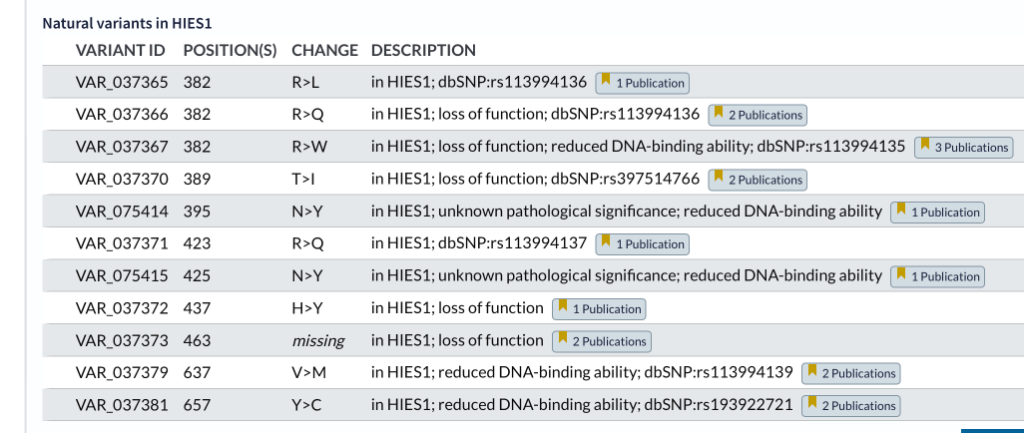
Hier ein Beispiel einer pathogenen Mutation:
Vom Gen STAT3 ist die Base 1145 von G (Guanin) nach A (Adenosin) verändert. So wird aus der 382. Aminosäure Arginin R (CGG) Glutamin Q (CAG). Dies heißt dann wissenschaftlich: R382Q

Links ein Ausschnitt der DNA Sequenz von STAT3. Oben ist die korrekte Sequenz unten die Mutation in grün eingekreist. G wird zu A.
Rechts ist ein Ausschnitt der Proteinsequenz von STAT3. Oben ist die korrekte Sequenz unten die Mutation in grün eingekreist. R wird zu Q.
Diese Mutation (R382Q) ist in der DNA-Bindungsregion von STAT3. Das heißt, dass eine große Anzahl der STAT3-Dimere nicht an die DNA binden können. Diese wurde auch im Nature Paper von 2007 nachgewiesen (3).

Das Protein heißt: Signal Tansducer and Activator of Transcription 3
Ganz unten steht DNA binding site (DNA-Bindungsregion)
Das Protein von STAT3
Das vom Gen STAT3 codierte Protein heißt Signal Tansducer and Activator of Transcription 3 und ist ein Mitglied der STAT Proteinfamilie.
Als Reaktion auf Zytokine und Wachstumsfaktoren werden die Mitglieder der STAT Familie von den rezeptorassoziierten Kinasen phosphoryliert und bilden dann Homo- oder Heterodimere, die in den Zellkern verlagert werden.
Ein Proteindimer ist ein makromolekularer Komplex, der aus zwei oder mehreren Proteinen besteht. Hier wird dann auch klar, warum das “gesunde” Gen das mutierte nicht ersetzten kann. Die Wahrscheinlichkeit, dass ein Heterodimer aus den “richtigen” Proteinen (Wildtyp) entsteht, ist relativ gering. Die Heterodimere zwischen Mutanten (LOF)- und Wildtyp-STAT3-Molekülen können also nicht mehr an der DNA binden und dort die Transkription bestimmter Gene einschalten. Also wird eine Reihe wichtiger Protein nicht mehr hergestellt. (3)
Aber es bietet auch eine Chance genau hier anzusetzen und das LOF-Protein aus dem Verkehr zu ziehen. Könnte man die LOF-Proteinversion blockieren oder abfangen, käme nur das funktionierende Protein zum bilden der Heterodimere zum Einsatz. Vielleicht könnte dies mit Antikörpern gegen das Peptid RGSQKFN gelingen. Auch könnte man durch Antisense Nukleotide die mRNA blockieren.
Im Zellkern wirken die STAT3-Dimere als Transkriptionsaktivatoren. Das heißt dass diese Dimere als “Einschaltknopf” für die Herstellung bestimmter anderen Proteine benötigt werden, also dass bestimmte andere Proteine produziert werden.
Das Protein wirkt nach Phosphorylierung auf verschiedene Zytokine und Wachstumsfaktoren wie IFN, EGF, IL5, IL6, HGF, LIF und BMP2. STAT3 vermittelt also die Expression einer Vielzahl von Genen und spielt somit eine Schlüsselrolle bei vielen zelluläre Prozesse wie Zellwachstum und Apoptose.
STAT3 spielt auch eine Rolle bei der Regulierung der Reaktion des Wirts auf virale und bakterielle Infektionen. Mutationen in diesem Gen werden auch als Multisystem-Autoimmunerkrankung und natürlich mit dem HIES assoziiert.
Faktoren zu Krankheitsursachen
Die DNA-bindende Domäne (DBD) der STAT3-Proteine hat eine Ig-ähnliche Faltung.
Mutationen in den DNA-bindenden Domänen, werden mit Krankheiten wie Autoimmunität (HIES), Immunschwäche und Krebs in Verbindung gebracht.
Die Regulation von STAT3 ist streng kontrolliert, da entweder Inaktivierung oder Hyperaktivierung zu einer Erkrankung führt. Die STAT3-Aktivierung wird durch verschiedene Zytokine und Wachstumsfaktoren über verschiedene Rezeptoren stimuliert. Wenn Zytokine an ihre Rezeptoren binden, werden rezeptorassoziierte JAKs aktiviert, um STATs zu phosphorisieren, die wiederum dimerisieren und in den Zellkern verlagert werden, wo sie Zielgene aktivieren.
Ein entscheidender Parameter ist die Rolle von STAT3 bei der Signaltransduktion und Aktivierung mehrerer Zytokine, darunter IL-6, IL-10, IL-11, IL-17, IL-21, IL-22, IL-23, Leukämiehemmer Faktor, Oncostatin M, Cardiotropin-1, Cardiotropin-ähnliches Zytokin und ciliärer neurotropher Faktor. Bei HIES-Patienten wurde eine beeinträchtigte Differenzierung und Signalgebung von Th17-Zellen nachgewiesen.
Keratinozyten und Bronchialepithelzellen zeigen eine viel stärkere Abhängigkeit als andere Zelltypen von Th17-Zytokinen für ihre Produktion von Chemokinen und antibakteriellen Peptiden, was die charakteristischen Haut- und Lungenkomplikationen der Krankheit erklärt.
Darüber hinaus wird angenommen, dass sich Basalzellen nach einer Epithelverletzung vermehren, um das freigelegte Epithel zu bedecken und IL-6 lokal zu produzieren. Die anschließende IL6/STAT3-Signalgebung fördert die Differenzierung der Basalzellen in Flimmerzellen und hemmt die Differenzierung der sekretorischen Zellen durch Hemmung der Notch 1-Expression und Hochregulierung von Zilienbiogenese-Genen wie Mcidas und Foxj1.
Diese Flimmer- und Sekretionszellen sind Schlüsselkomponenten des mukoziliären Clearance-Apparats. Als mukoziliäre Clearance bezeichnet man den vom respiratorischen Epithel getragenen Selbstreinigungsmechanismus der Bronchien. Epithelschäden und nachfolgende infektionsbedingte Atemwegsentzündungen bei AD-HIES verändern die Regulation dieser normalen Reparaturmechanismen, was die deutliche Ansammlung von persistenten Sekreten erklärt, die fest an den Atemwegswänden haften können.
Beispielsweise hängen IL-6-Rezeptoren von den Tyrosinkinasen JAK1 oder JAK2 ab, die mit dem zytoplasmatischen Schwanz von gp130 assoziieren und zu STAT3-Phosphorylierung, Dimerisierung und Translokation in den Zellkern führen. Dies führt zu einer weiteren IL-6-Produktion und einer Hochregulierung antiapoptotischer Gene, wodurch verschiedene zelluläre Prozesse gefördert werden, die für das Fortschreiten des Krebses erforderlich sind.
Andere Aktivatoren von STAT3 umfassen nicht nur die Zytokine sondern auch die Lipopolysaccharid-Aktivierung der Toll-like-Rezeptoren TLR4 und TLR9.
STAT3 wird bei zahlreichen Krebsarten aktiviert. Es hat sich gezeigt, dass es eine bedeutende Rolle bei der Förderung von Krebszellen spielt.

Förderung von Krebszellen durch STAT3
Hier ist das Protein an drei hauptsächlichen Wegen beteiligt
- Hochregulierung antiapoptotischer Gene. Also die Förderung der Proliferation (schnelles Wachstum beziehungsweise Vermehrung von Gewebe) und des Überlebens der Krebszellen.
- Verhinderung der Differenzierung zu funktionellen Zellen und Blockierung der T-Zell-Funktion über andere Wege.
- STAT3 reguliert die Mitochondrienfunktionen sowie die Genexpression durch epigenetische Mechanismen; seine Aktivierung wird durch die Überexpression von Bcl-2 über einen Anstieg des mitochondrialen Superoxids induziert. Die Regulatoren und Funktionen von JAK-STAT3 in Tumoren spielen hier eine wichtige Rolle
Die Inzidenz maligner Erkrankungen bei Patienten mit AD-HIES wird auf etwa 7 % geschätzt. Etwa 25 Fälle von Lymphomen wurden bei etwa 300 Patienten mit AD-HIES gemeldet. Das Durchschnittsalter von AD-HIES-Patienten bei der Präsentation des Lymphoms ist 19 Jahre alt und reicht von 4 bis 69 Jahren (4). Es scheint eine Veranlagung für aggressive Lymphome mit einem hohen klinischen Stadium zu geben (5).
Es wurde zunächst vermutet, dass die Überlebensrate mit Lymphomen beim Hyper-IgE-Syndrom niedriger ist als in der Allgemeinbevölkerung, aber Patienten mit Hyper-IgE-Syndrom wurden oft weniger aggressiv behandelt als diejenigen, die immunkompetent waren, da befürchtet wurde, dass die zugrunde liegende Immunschwäche das Ergebnis beeinflussen könnte . Hämatologische oder infektiöse Komplikationen sind häufiger, da das Immunsystem dieser Patienten zu Verzögerungen im Chemotherapieplan und zu weiteren Dosisanpassungen führt. Darüber hinaus gibt es immer Bedenken hinsichtlich der Haut, wenn eine lokale Strahlentherapie erforderlich ist (1).
Vergleich zu Mukoviszidose
Da immer wieder der Vergleich mit Mukoviszidose kommt, möchte ich hier kurz den Unterschied zu HIES erläutern:
Mukoviszidose wird durch eine Veränderung im Mukoviszidose-Gen, dem CFTR-Gen, verursacht. CFTR steht für das englische Wort „Cystic Fibrosis Transmembrane Conductance Regulator“. Ein solcher Regulator ist ein Protein, das auf der Oberfläche einiger Zellen sitzt und wie ein Kanal wirkt. Die Mutation im CFTR-Gen führt zu einem defekten Kanal in der Zelloberfläche. Dieser Kanal sorgt normalerweise dafür, dass Salz und Wasser aus der Zelle ein- und ausströmen. Ist der Kanal defekt, kommt es zu einem Ungleichgewicht im Salz-Wasser-Haushalt der Zelle. Deshalb enthält der Schleim, der die Zellen bedeckt, bei Mukoviszidose zu wenig Wasser und wird dadurch zäh. Bei Mukoviszidose ist ein Gen auf Chromosom 7 fehlerhaft. Die Krankheit wird autosomal rezessiv vererbt. Im Gegensatz zu HIES, das meist spontan auftritt und dominant negativ ist.
Beide Krankheiten sind selten und die Betroffenen haben, unter vielen anderem, mit verschiedenen Bakterienstämmen in der Lunge zu kämpfen.
Phagentherapie
HIES Patienten haben, wie oben erwähnt, mit verschiedenen Bakterienstämmen zu kämpfen.
- Staphylococcus aureus.
Über Staphylococcen habe ich schon einiges geschrieben: https://hmjaag.de/staphylokokken/ - Streptococcus pneumoniae.
Das sind grampositive Bakterien die morphologisch zu der Gruppe der Diplokokken gehören, also paarweise gelagert sind und Erreger der Pneumonie (Lungenentzündung) sind. (Wikipedia) - Pseudomonas aeruginosa.
Dies ist ein gramnegatives, oxidasepositives Stäbchenbakterium der Gattung Pseudomonas. Die Namensgebung bezieht sich dabei auf die blau-grüne Färbung des Eiters bei eitrigen Infektionskrankheiten. P. aeruginosa ist ein wichtiger Krankenhauskeim, der gegen mehrere Antibiotika resistent ist. (Wikipedia) - Mykobakterien.
Die Mykobakterien (Mycobacterium) bilden eine Gattung bestehend aus ca. 100 Arten. Sie sind die einzigen Vertreter der Familie Mycobacteriaceae. Zu ihnen gehören als Auslöser von Mykobakteriosen sowohl Krankheitserreger des Menschen wie Mycobacterium tuberculosis (Tuberkulose) und Mycobacterium leprae (Lepra) als auch Krankheitserreger von Tieren wie der Erreger der Rindertuberkulose (Mycobacterium bovis). Daneben gibt es aber auch freilebende Arten. (Wikipedia) - Haemophilus-Arten.
Sind eine Gattung stäbchenförmiger gramnegativer Bakterien aus der Familie der Pasteurellaceae. Die 16 Arten dieser Bakterien sind unbewegliche Stäbchen, die mitunter in den Schleimhäuten von Menschen und Tieren leben und Erkrankungen auslösen können. Beinahe alle Haemophilus-Arten sind in der Lage, ohne Sauerstoff zu überleben (fakultativ anaerob); allerdings sind sie meistens eher aerob. Der Name der Gruppe kommt von ihrer besonderen Vorliebe für Nährböden mit Blut- oder Hämoglobinzusätzen, auf denen sie in Kultur gehalten werden können. (Wikipedia)
Haemophilus infuenza
Da Haemophilus infuenza bei HIES Patienten eine übergeordnete Rolle spielt, möchte ich hier etwas mehr darauf eingehen.
Die invasive Haemophilus-influenzae-b-Infektion ist eine der schwersten bakteriellen Infektionen in den ersten fünf Lebensjahren. Der Erreger kommt nur beim Menschen vor und findet sich vor allem auf den Schleimhäuten der oberen Atemwege. Erreger Haemophilus influenzae vom Typ b (Hib) können fieberhafte Infektionen des Nasenrachenraums mit Mittelohr-, Nasennebenhöhlen- und Lungenentzündungen verursachen. Komplikationen können sein:
Hirnhautentzündungen (Meningitis), Entzündungen des Kehldeckels (Epiglottitis), akute bakterielle Infektion der Haut (Cellulitis), bakterielle Infektion, die mehrere Gelenke im Körper betrifft (septische Arthritis), Ansammlung von Eiter in einer präformierten Körperhöhle oder einem Hohlorgan (Empyem), Infektion im Inneren des Auges (Endophthalmitis), Harnwegsinfektionen, Abszesse, Infektion des Knochens und des Knochenmarkes (Osteomyelitis) und Endokarditisund Anwesenheit von Bakterien im Blutkreislauf (Bakteriämie). (7)
Der Hib-Konjugatimpfstoff schützt wirksam vor dem Kapselpolysaccharid Typ „b“ und hat die Rate der Hib-Infektionen in größerem Maße gesenkt. Derzeit ist nicht-eingekapselter H. influenzae, auch nicht typisierbarer H. influenzae (NTHi) genannt, für die Mehrzahl der Fälle von Mittelohrentzündung, Sinusitis und Lungenentzündung bei Patienten verantwortlich, die bereits mit dem Impfstoff immunisiert wurden. Die Übertragung erfolgt durch Einatmen von Atemwegssekrettröpfchen infizierter Personen oder durch direkten engen Kontakt.(7)
Hib Infektionen entwickeln oft Biofilm-ähnliche Kolonien. Die anfängliche Antibiotikawahl ist ein Cephalosporin der dritten Generation. Antibiotikaresistenz ist ein besorgniserregendes Problem.
In der Literatur wurden bisher sieben biologisch aktive dsDNA-Phagen beschrieben, die Haemophilus influenzae infizieren (8, stand 2020). Zu ihnen gehört auch der HP1-Phagen, der zur Familie der Myoviridae gehört. Das Genom des HP1-Phagen (NC_001697.1) wurde sequenziert, ist 32 kbp lang und kodiert für 41 potenzielle Proteine in fünf plausiblen Transkriptionseinheiten (8).
Zusätzlich wurden 2020 noch vier weitere Phagen beschrieben (9)
Meiner Meinung nach steht ein HIES Immundefekt mit den involvierten Proteinen und oben beschriebenen Zusammenhängen einer erfolgreichen Phagentherapie nicht im weg. Auch sehe ich keine größeren Risiken für Personen mit LOF-STAT3. Ich möchte aber darauf hin weisen, dass dies die Einzelmeinung einer Molekularbiologin ist. Für weitere Informationen zu Phagentherapie verweise ich auf meine Linkliste:
Stammzelltransplantation
Der Neustart des Immunsystems mittels hämatopoetischer Stammzelltransplantation (HSCT) ist ein auf Heilungen ausgerichtetes, aber risikoreiches Therapieprinzip, das mit starken Nebenwirkungen einhergeht. Die Stammzelltherapie kommt in Deutschland nur in spezialisierten Zentren als „ultima ratio“ zum Einsatz, wenn zuvor durchgeführte Therapien keinen Erfolg zeigten.
Sieben Fälle mit AD-HIES, die von 1998 bis 2018 einer Knochenmarktransplantation unterzogen wurden, wurden veröffentlicht. Das Ergebnis der ersten beiden Fälle war enttäuschend, da der erste Patient, der 1998 gemeldet wurde, 6 Monate nach der Transplantation an einer diffusen Alveolarschädigung starb und der zweite, der 2000 gemeldet wurde, fast 4 Jahre nach der Transplantation eine Staphylokokken– und pseudomonale Hautsepsis entwickelte , trotz vollständigem Spender-Chimärismus (also nach einer erfolgreichen Transplantation). Es gibt jedoch keine Aktualisierung bezüglich des medizinischen Zustands dieses Patienten nach dem Jahr 2000. (1)
Die von Oikonomopoulou (1) operierten zwei Patienten wurden nach der Transplantation 22 und 18 Jahre lang beobachtet. Es ginge ihnen gut, sie mussten nach der Transplantation nicht ins Krankenhaus eingeliefert werden und sind beeindruckend frei von Infektionen und nicht-immunologischen Manifestationen der Krankheit. Insbesondere Hautläsionen, Osteoporose und sogar das grobe Erscheinungsbild der Gesichtshaut mit ausgeprägten Poren verschwanden nach und nach. Transplantationsindikation war die Entwicklung von Non-Hodgkin-Lymphome (NHL).
Patel et al. berichteten 2015 über einen Patienten, der im Alter von 14 Jahren von seinem haploidentischen Vater nach einer Konditionierung mit reduzierter Intensität (RIC) transplantiert wurde (der Patient erhielt ein Transplantat ohne T-Zellen). Nach 3,5 Jahren Nachbeobachtung ist der Patient infektionsfrei, mit vollem Spender-Chimärismus. Indikation zur Transplantation war die zunehmende Schwere rezidivierender Infektionen, hauptsächlich die Entwicklung einer Pneumatozele und das Vorliegen rezidivierender Hautabszesse. (1)
Yanagimashi et al. berichteten 2016 über zwei weitere Patienten mit AD-HIES, die aufgrund einer erhöhten Schwere der Infektion transplantiert wurden. Der erste Patient war aufgrund von Pneumatozelen und Abszessen einer bilateralen Lobektomie unterzogen worden. Der zweite Patient war aufgrund einer Aspergillose einer totalen rechten Lobektomie (Entfernung eines Lungenflügels) unterzogen worden. Die Hospitalisierungshäufigkeit der beiden Patienten nach der Transplantation nahm ab. Darüber hinaus litten die beiden Patienten vor der Transplantation auch an Haut- und Mundpilzinfektionen, hatten aber danach keine derartigen Infektionen mehr. Wahrscheinlich wegen der normalen IL-17-vermittelten Immunität nach der Transplantation. Sie verbesserten sich daher teilweise hinsichtlich der Infektanfälligkeit. Dennoch zeigten beide Patienten nach der Transplantation pulmonale Komplikationen, d. h. rezidivierende pulmonale Aspergillose und rezidivierende Pneumatozelen, was darauf hindeutet, dass die Stammzellentransplantation nur eine begrenzte Wirkung bei der Verhinderung des Fortschreitens der Pneumatozele hatte. Die Knochenbrüchigkeit blieb auch nach der HSCT bei diesen beiden Patienten mit AD-HIES bestehen. (1)
Angesichts der geringen Anzahl von Patienten, die einer Transplantation unterzogen wurden, und des Fehlens neuerer klinischer Daten zu den gemeldeten Patienten ist der Grad des Chimärismus, der zur Korrektur der Krankheit erforderlich ist, nicht bekannt. Fünf von sieben Patienten hatten einen vollständigen Spender-Chimärismus, drei von ihnen geht es gut. Der vierte Patient hat eine geringere Häufigkeit von Krankenhausaufenthalten, und für den fünften Patienten fehlt der aktuelle Status. (1)
Überlegungen zu einer HSCT von Oikonomopoulou und Goussetis
Unter Berücksichtigung der oben erwähnten Daten zu HIES-Patienten schlagen Christina Oikonomopoulou und Evgenios Goussetis (1) vor, dass eine frühe HSCT eine Option für Patienten sein sollte, die einen HLA-übereinstimmenden verwandten oder nicht verwandten Spender haben. Diese Patienten sollten bereits in frühen Lebensjahren einen aggressiveren Verlauf haben und besonders hohe Rezidivraten von Atemwegsinfekten, da diese eine Tendenz zur chronischen Beeinträchtigung aufweisen. Eine HSCT wäre bei diesen Patienten sorgfältig in Betracht zu ziehen. Ein junger Patient würde sich höchstwahrscheinlich mit den geringsten Atemproblemen vorstellen und hat noch kein Lymphom, vaskuläre Anomalien, Skoliose und Osteoporose entwickelt. Daher könnte eine frühe HSCT ihre Entwicklung verhindern und eine normale körperliche Entwicklung des Kindes versprechen.
Von den sieben Patienten, die bisher transplantiert wurden, haben drei einen hervorragenden Verlauf nach der Transplantation, was sowohl Infektionen als auch nicht-immunologische Merkmale betrifft. Einer der sieben Patienten verstarb an transplantationsbedingter Mortalität und ein weiterer Patient entwickelte trotz Vollspender-Chimärismus eine Hautsepsis. Die verbleibenden zwei Patienten entwickelten Lungenkomplikationen nach der HSCT, jedoch in einer verbesserten Weise, die weniger Krankenhauseinweisungen erforderte. Diese beiden Patienten waren beide aufgrund von Abszessen und Aspergillose einer Lobektomie unterzogen worden. Die restlichen Lungen hatten auch Pneumatozelen. Mit anderen Worten, die beiden Patienten wurden mit einer schweren Lungenbehinderung transplantiert. Wahrscheinlich hätte das Ergebnis anders ausfallen können, wenn die Entscheidung bezüglich HSCT früher getroffen worden wäre. (1)
Mein Fazit
Da ich jetzt viel gelesen und oben zitiert habe, maße ich mir hier ein kleines Fazit zur Stammzelltransplantation an.
Meiner Meinung nach sollte der Zustand des Patienten und bestimmte Umstände auf jeden Fall berücksichtigt werden. Die bestimmten Umstände sind:
- Gibt es geeignete Stammzellenspender in der Familie?
Dies sollte auch in Hinblick auf eine mögliche Krebserkrankung so früh wie möglich einfach mal unverbindlich evaluiert werden. - Hat der Patient das EBV (Epstein-Barr-Virus)?
Es gilt als gesichert, dass das Epstein-Barr-Virus, (Erreger des Pfeiffer‘schen Drüsenfiebers) zur Entwicklung eines Hodgkin-Lymphoms beitragen kann. Das EBV und Lymphome sind Probleme eines HIES Patienten. Wenn also ein Mensch mit einer LOF-STAT3 Mutation es schafft frei von EBV zu bleiben, so rate ich von einer Stammzellentransplantation ab, wenn man ansonsten halbwegs gesund ist. Wobei man aber wissen muss, dass die meisten Lymphome von HIES-Patienten negativ auf EBV getestet wurden (10). - Wie weit ist die Forschung?
Eine Therapie die das mutierte LOF-STAT3 “ausschalten” könnte wäre sicher vorzuziehen, da die Patienten meist ein gesundes Gen haben, das dann einspringen kann. Mit den neuen RNA Impfstoffen, könnte man hier relativ schnell und einfach etwas entwickeln. So könnte man das LOF-STAT3-Protein mit Antikörpern einfangen.
Problem ist hier der Charakter der Krankheit als seltene Krankheit und selbst innerhalb der Krankheit gibt es verschiedene Mutationen. Für jede einzelne müsste man extra einen maßgeschneiderten Impfstoff entwickeln. Eine solche Therapie würde kein Geld einbringen, sondern nur viel kosten. Ich möchte aber den Konzernen zur Überlegung mitgeben, dass man mit diesem Prinzip jede dominant negative Genkrankheit behandeln könnte. - Wie weit sind die Kliniken mit der Stammzellentransplantation und den negativen Auswirkungen?
Blutstammzellen sind die „Mutterzellen“ aller Blutzellen. Aus ihnen entwickeln sich im Knochenmark die roten und weißen Blutkörperchen (Erythrozyten, Leukozyten) und die Blutplättchen (Thrombozyten). Die Stammzellen für die Transplantation können entweder aus dem Knochenmark (Knochenmarktransplantation) oder aus dem Blut (periphere Blutstammzelltransplantation) gewonnen werden.
Nun wird der Patient mit Hilfe einer hochdosierten Chemotherapie – zum Teil in Kombination mit einer Ganzkörperbestrahlung – so intensiv behandelt, dass sein gesamtes Knochenmark und im Idealfall auch alle erkrankten Zellen zerstört werden. Diese vorbereitende Behandlung wird auch Konditionierung genannt. Anschließend werden dem Patienten – als Ersatz für das zerstörte Knochenmark – gesundes Knochenmark oder gesunde Stammzellen von einem geeigneten Spender wie bei einer Bluttransfusion in die Vene übertragen. Die Blutstammzellen wandern in die Markhöhlen der Knochen, siedeln sich dort an und beginnen neue funktionstüchtige Blutzellen zu bilden. In der Regel dauert es durchschnittlich drei Wochen, bis das fremde Knochenmark angewachsen ist und sich die Blutwerte erholt haben.
Wenn die Transplantation erfolgreich ist, d.h. wenn die Blutbildung wieder in Gang kommt und tatsächlich keine kranken Zellen die Vorbehandlung überlebt haben, ist der Patient dauerhaft geheilt. (UKE Hamburg)
Ernährung bei HIES
Als letzten Abschnitt möchte ich hier noch die Ernährung einfügen, da man damit sicher einiges machen kann und auch muss.
Wie die Symptome der Krankheit behandelt werden, dafür gibt es von der behandelnden Klink einen Leitfaden. Die Behandlung stützt sich auf regelmäßige Blutuntersuchungen und Abstriche. Dies ist ganz wichtig, dass man so einen individuellen Überblick hat. Die Behandlung muss regelmäßige Gaben von verschiedenen Antibiotika und auch Cortison beinhalten. Die Auswirkungen kann man mit der Ernährung etwas kontrollieren.
Mikrobiom
Durch die Medikamente wird das Mikrobiom vollkommen gestört. Deshalb empfiehlt sich möglichst frisch und zuckerarm zu essen. Fermentierte und vergärte Lebensmittel, wie Sauerkraut, Kimchi, Tempeh, Kombucha und frisches Gemüse (am besten roh) und auch frisches Obst. Wenn man Obst nicht als Saft trinkt kann man den Zuckergehalt (Fructose) hier vernachlässigen. Fruchtsäfte sind zu meiden. Anstatt Süßkram lieber eine Banana oder auch Trockenobst und Nüsse. Bei Trockenobst nur Bio und ohne Zusätze (Schwefel) kaufen, oder vielleicht sogar selber machen. Wenn Milchprodukte, dann nur vergärt, wie Joghurt oder Kefir. Milchprodukte möglichst fettarm, da am Fett der Milch die ganzen Hormone “kleben”. Hormone sind auch in Biomilch!
Der Zucker ist ein großes Problem, da dieser von Pilzen gerne genommen wird. So sind Pilzinfektionen (Aspergillus und Pneumocystis jirovecii) bei HIES Patienten eh häufiger. Aber durch die regelmäßige Gabe von Antibiotika (sie sein muß!) werden Pilzinfektionen gefördet.
Die Zusammenhänge hatte ich mal hier erklärt:
Malignes Lymphom
Maligne Lymphome sind eine Gruppe von bösartigen Erkrankungen des Lymphsystems. Dazu gehören Lymphknoten, Mandeln, Milz, Knochenmark und andere Organe.
Die Krankheit beruht auf einer bösartigen Umwandlung von Lympfzellen. Je nachdem, welcher Zelltyp betroffen ist, entwickeln sich verschiedene Lymphomtypen, die sich hinsichtlich der Ausprägung, des Verlaufs, der Beeinflussbarkeit durch die Therapie und der Prognose unterscheiden. Traditionell wird zwischen dem Hodgkin-Lymphom und der heterogenen Gruppe der Non-Hodgkin-Lymphome (NHL) unterschieden.
Da HIES Patienten hier ein größeres Risiko haben ist eine regelmäßige Blutuntersuchung lebenswichtig!
Daneben sollten sie alles, was im Verdacht steht, Lymphome zu fördern, meiden. Ein gesunder Mensch kann sicher sehr viele “Umweltgifte” gut wegstecken. So gibt es ja auch Raucher, die mit 90 Jahren noch fröhlich vor sich hin qualmen.
Nicht umsonst gibt es momentan in den USA viele Klagen gegen Bayer, weil Glyphosat krebserregend sein soll. Oben in meinem Artikel (https://hmjaag.de/mikrobiom-glyphosat) ist erläutert warum. Glyposat lässt sich sehr schlecht meiden und wurde schon im Urin von sehr vielen Kindern gefunden.
So wird von den verantwortlichen Stellen oft gesagt, dass die Menge Glyphosat im Urin der Kinder unbedenklich sei. “Selbst Kinder würden bei diesem höchsten Gehalt weniger als ein Prozent der duldbaren täglichen Aufnahmemenge erreichen.” (BfR). Aber Eltern sollten sich nicht nur um den Grenzwert Sorgen machen, der angeblich unbedenklich sei, sondern auch darum, dass im Urin von eigentlich allen Kindern Abbauprodukte von Glyphosat gefunden werden.
Neben Glyphosat sind noch sehr viele andere Chemikalien im Verdacht. Wie diese alle zusammenwirken ist ebenso nicht erforscht, wie die Tatsache, dass eine lethale Dosis immer noch an Ratten bestimmt wird. Also die Giftigkeit einer Chemikalie wird bestimmt, indem man Ratten damit tötet. Da weiß man nichts über Langzeiteffekt oder auch wie das alles zusammenwirkt. Selbst in Glyphosat das der Landwirt ausbringt sind noch andere Zusätze, wie z.B. Vernetzungsmittel. Ein alter Artikel von mir hat sich mal mit den zugelassenen Pestiziden beschäftigt.
Wie kann man das umgehen?
Eigentlich gar nicht. Aber minimieren kann man dies durch den konsequenten Kauf von Bio Produkten. Im Biolandbau sind die meisten Chemikalien verboten und es gibt nur eine geringe Abdrift. Hier sollte man nicht nur bei Obst- und Gemüse darauf achten, sondern vor auch bei Brot und Getreide. Dann die Weichmacher und andere Chemikalien bei Plastik, Spielzeug, Möbeln, Teppichen, Kleidung und Hygieneartikel nicht aus den Augen lassen.
Ich diskutiere gerne in den Kommentaren! Auch können sich Betroffene hier über mich vernetzten:
info at hmjaag.de
(1) Autosomal dominant hyper-IgE syndrome: When hematopoietic stem cell transplantation should be considered? Christina Oikonomopoulou and Evgenios Goussetis, doi:10.1111/petr.13699, Pediatric Transplantation, (2020).
(2) Selective inhibition of STAT3 signaling using monobodies targeting the coiled-coil and N-terminal domains, Madej T, Lanczycki CJ, Zhang D, Thiessen PA, Geer RC, Marchler-Bauer A, Bryant SH. ” MMDB and VAST+: tracking structural similarities between macromolecular complexes. Jan; 42(Database issue):D297-303, Nucleic Acids Res. (2014).
(3) Dominant-negative mutations in the DNA-binding domain of STAT3 cause hyper-IgE syndrome. Yoshiyuki Minegishi et al., doi:10.1038/nature06096, Nature(2007).
(4) Autosomal dominant hyper‐IgE syndrome: When hematopoietic stem cell transplantation should be considered? Gernez Y, Freeman AF, Holland SM, et al. J Allergy Clin Immunol Pract.(2018)
(5) Non-Hodgkin’s lymphoma in Job’s syndrome: a case report and literature review. Leonard GD, Posadas E, Herrmann P, et al. Leukemia Lymphoma (2004)
(6) Life-Threatening Pneumopathy and U urealyticu(m in a STAT3-Deficient Hyper-IgE Syndrome Patient. Guillaume, D. et al. https://doi.org/10.1542/peds.2016-0845. Pediatrics (2017)
(7) Haemophilus Influenzae. Zoia E. Khattak, Fatima Anjum. StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing (2022)
(8) Haemophilus influenzae HP1 Bacteriophage Encodes a Lytic Cassette with a Pinholin and a Signal-Arrest-Release Endolysin, Adamczyk-Popławska, M. et al. Int. J. Mol. Sci. 2020, 21(11), 4013; https://doi.org/10.3390/ijms21114013. International Journal of Molecular Sciences (2020)
(9) New Phage cocktail against infantile Sepsis bacteria, Sadeq Abdulridha Gatea Kaabi, Hadeel Kareem Musafer, DOI: 10.1016/j.micpath.2020.104447, Microbial Pathogenesis (2020)
(10) STAT3 Hyper-IgE Syndrome—an Update and Unanswered Questions. Christo Tsilifis et al. doi: 10.1007/s10875-021-01051-1, Journal of Clinical Immunology (2021)
Text und Abbildungen dürfen unter den Bedingungen der Creative Commons Attribution Share-Alike license (CC-BY-SA) gerne ganz oder teilweise kopiert und zitiert werden.